Kelebihan dan Kekurangan Teori Atom Rutherford
Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri atas proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya elektromagnetik. Sekumpulan atom demikian pula dapat berikatan satu sama lainnya, dan membentuk sebuah molekul. Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan disebut sebagai ion. Atom dikelompokkan berdasarkan jumlah proton dan neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
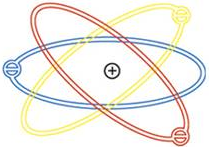 |
| Model Atom Rutherford |
Atom adalah substansi dasar penyusun materi. Dalam penemuan serta perkembangannya, ada beberapa model atom yang dicetuskan oleh para ilmuan. Salah satunya adalah Teori Atom Rutherford yang dikemukakan oleh Ernest Rutherford yang dibantu oleh Hans Geiger, dan Ernest Marsden pada tahun 1911. Dilansir dari Lumen Learning, Rutherford mengemukakan bahwa semua muatan positif dan sebagian massa atom terkonsentrasi di ruang yang sangat kecil bernama nukleus (inti atom) di bagian dalam atom. Di dalam nukleus terdapat proton dan juga neutron yang berkontribusi pada hampir semua massa atom. Rutherford juga mengemukakan bahwa sebagian volume atom diisi oleh substansi bernama elektron. Elektron yang bermuatan negatif terdistribusi disekitar inti atom, membentuk sebagian besar volume atom.
Baca juga:
Inti atom tersebut didapatkan melalui percobaan hamburan sinar alfa. Disadur dari Encyclopedia Britannica, teori atom Rutherford merupakan hasil percobaan menembak lapisan tipis emas dengan partikel alfa.
Rutherford memperhatikan bahwa partikel alfa yang dipancarkan melalui lubang pada pelat fotografi akan menghasilkan gambar yang tajam, sedangkan partikel alfa yang dipancarkan melalui mika akan terlihat buram. Dilansir dari Khan Academy, eksperimen sinar alfa foil emas Rutherford menunjukkan bahwa atom sebagian besar adalah ruang kosong dengan inti kecil, padat, dan bermuatan positif. Hal ini mematahkan teori atom J.J. Thomson yang menyatakan bahwa elektron berada dalam lautan bermuatan positif.
Kelebihan teori atom Rutherford:
- Menemukan inti atom atau nukleus dari eksperimennya
- Menemukan atom merupakan inti (terdiri dari proton dan neutron) yang dikelilingi oleh elektron yang bermuatan negatif
- Menggambakan gerak elektron di sekitar inti atom
- Menemukan jari-hari inti atom dan juga jari-jari atom
- Menemukan bahwa inti atom sangat kecil namun berkontribusi sebagai hampir keseluruhan massa atom
- Menemukan bahwa elektron sangat ringan namun berkontribusi sebagai hampir keseluruhan volume atom
- Mudah dipahami untuk menggambarkan struktur atom yang rumit.
Kekurangan teori atom Rutherford:
- Tidak bisa menjelaskan spektrum garis atom hidrogen
- Tidak bisa menjelaskan stabilitas atom
- kompas.com
- wikipedia.org

